EU向け畜産食品における動物用医薬品に関する規則への対応
最終更新日:2025年6月11日
EU向けに牛肉等の畜産食品を輸出する際には、動物用医薬品の使用に関して、国内の残留基準値を超過していなくても、EUの残留基準値を超過した場合は輸出することができませんので、休薬期間等に注意が必要です。
また、EU規則においては、畜産食品の由来する動物に対して生涯にわたって使用が禁止されている動物用医薬品等も定められています。
EU向けに輸出する牛肉においては、衛生証明書を発給する際に当該動物用医薬品等が生涯不使用である牛由来であることを確認する必要があるため、出生からと畜されるまでの間の不使用を証明する体制を整えています。現状、以下の2つのEU規則に基づいて対応が必要となりますので、輸出する際にはご留意ください。
1.EUにおける成長促進作用のあるホルモン剤の使用規制に伴う輸入規制
EU規則第2022/2292号に基づき、EU規則第96/22号で規定される、成長促進作用のあるホルモン剤の使用を制限するため、以下の成分を含む薬剤は、目的のいかんを問わず、生涯使用が禁止されています。
1スチルベン類
2抗甲状腺薬
3エストラジオール17β及びその類似物質
我が国において、雌牛の人工授精時の発情誘起や受精卵移植時の発情同期化、繁殖障害の治療を目的として承認されているエストラジオール安息香酸エステルは、エストラジオール17βの類似物質(エステル様誘導体)に該当します。このため、EU等向け輸出牛肉由来牛に当該物質を含有する製剤を使用することはできません。EU規制当局より、EU等向け輸出牛肉由来牛に対して、出生からと畜されるまでの間、当該物質を含有する製剤を使用していないことを公的機関が確認した上で衛生証明書を発給する体制をとるよう求められたことから、令和7年5月に本体制を構築しました。なお、令和7年6月23日以降に衛生証明書を発行する畜産物から適用開始となります。
なお、エストラジオール安息香酸エステルは肥育牛には使用されません。我が国では、肥育など成長促進を目的としたホルモン剤は承認されていません。
https://www.maff.go.jp/j/syouan/tikusui/siryo/hiiku.html
事業者等向けオンライン説明会
EU等輸出に仕向けられる牛(牛肉)におけるEUの禁止薬剤の不使用確認体制についての説明会(2025年5月26日、28日、29日、30日開催)
説明会資料(PDF : 4,728KB)
(参考)EU等向け乳製品についての情報提供(PDF : 427KB)
Q&A(PDF : 250KB)
事業者等向けパンフレット等
繁殖農家向けパンフレット(PDF : 444KB)
酪農家向けパンフレット(PDF : 459KB)
肥育農家向けパンフレット(PDF : 475KB)
獣医師向けパンフレット(PDF : 491KB)
(様式例)EU等使用禁止薬剤不使用申告書1(WORD : 29KB)
(様式例)EU等使用禁止薬剤不使用申告書2(WORD : 29KB)
(様式例)EU使用禁止薬剤を使用しないことの合意書(WORD : 26KB)
2.EUにおける薬剤耐性対策強化のための輸入規制
EU規則第2023/905号に基づき、畜水産物の生産段階における抗菌剤等の使用が制限されています。この規則は2022年1月に制定されましたが、日本等のEU域外の国で生産された畜水産食品に適用されるのは2026年9月3日以降にEUを通関する製品です。
本規則において、以下が規定されています。
(ア)人医療に使用が限定される抗菌剤リスト(EU規則第2022/1255号のリスト)に掲載されている抗菌剤等が使用されていないこと
リストに掲載されている抗菌剤等のうち、日本において承認のある薬剤は、ホスホン酸誘導体(ホスホマイシン)のみ。
(イ)成長促進目的での抗菌剤等の投与が行われていないこと
事業者等向けオンライン説明会
牛肉輸出に係るEUの新たな動物用医薬品規則の発効に伴うEU等向け輸出牛肉の取扱いに係る説明会(2024年4月16日、17日、19日開催)
説明資料(PDF : 3,539KB)
(分割版:説明資料1(PDF : 2,071KB)、説明資料2(PDF : 1,377KB))
説明会当日の質疑応答(PDF : 239KB)
EUにおける新たな動物用医薬品規則及びアニマルウェルフェア規則に関する説明(2023年2月22日開催)
EUの新たな動物用医薬品規則に関する情報提供(2021年11月2日開催)
説明資料(PDF : 571KB)
説明会当日の質疑応答(PDF : 161KB)
事業者等向けパンフレット等
(参考)ホスホマイシンに変わるワクチンや抗菌剤の一覧(PDF : 332KB)
過去の経緯
EUに輸入される動物又は動物由来製品の承認第三国リストに関する実施規則((EU)2024/2598)の制定(2024年10月4日制定)
EUは、「第三国からEUに輸入される動物又は動物由来製品に対し特定の抗菌剤の使用を禁止する規則」((EU)2023/905)の第5条に規定されている「EUに輸入される動物又は動物由来製品の承認第三国リストに関する実施規則」((EU)2024/2598)を2024年10月4日に制定し、同年10月7日に官報にて公表しました。本規則は、第三国からEUに輸入される動物又は動物由来製品に対し特定の抗菌剤の使用を禁止する規則の適用と同一日である2026年9月3日から適用されます。
(参考)
EUの官報
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=OJ:L_202402598(外部リンク)
公的証明書に関する実施規則((EU)2024/399)の制定(2024年1月29日制定)
EUは、「第三国からEUに輸入される動物又は動物由来製品に対し特定の抗菌剤の使用を禁止する規則」((EU)2023/905)の第6条に規定されている「公的証明書に関する実施規則」((EU)2024/399)を2024年1月29日に制定し、同年2月12日に官報にて公表しました。本規則は同年9月3日から適用されます。
第三国からEUに輸入される動物又は動物由来製品に対し特定の抗菌剤の使用を禁止する規則の適用は、公的証明書に関する規則の適用日から24か月後です。
(参考)
EUの官報
https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=OJ:L_202400399(PDF:698KB、外部リンク)
第三国からEUに輸入される動物又は動物由来製品に対し特定の抗菌剤の使用を禁止する規則((EU)2023/905)の制定(2023年2月27日制定)
EUは、「第三国からEUに輸入される動物又は動物由来製品に対し特定の抗菌剤の使用を禁止する規則」((EU)2023/905)を2023年2月27日に制定し、同年5月4日付けで官報にて公表しました。本規則の適用は、本規則第6条に規定されている公的証明書に関する実施規則の適用日から24か月後に始まります。
EUの官報
https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=OJ:L:2023時11分:6:FULL(PDF:848KB、外部リンク)
PDFの3-6ページ目(全33ページ)に同規則が掲載
EUにおける人医療に使用が限定される抗菌剤を指定する規則((EU)2022/1255)の制定(2022年7月19日制定)
EUは、「人医療に使用が限定される抗菌剤を指定する規則」((EU)2022/1255)を2022年7月19日に制定し、同年7月20日付けで官報にて公表しました。本規則は2023年2月9日からEU加盟国で適用が開始されます。
この規則で指定された抗菌剤の中で、日本で動物用医薬品として承認されているのは「ホスホマイシン」です。
(参考)
EUの官報
https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=OJ:L:2022時19分:1:FULL&from=EN(PDF:1,273KB 外部リンク)
PDFの60-62ページ目(全86ページ)に同規則が掲載
EUの新たな動物用医薬品規則の検討状況(2022年3月17日時点)
2022年3月時点の情報を取りまとめた資料です。
(参考)
欧州医薬品庁(EMA)の提言案(2022年5月25日更新版)
https://food.ec.europa.eu/system/files/2022-06/ah_vet-med_imp-reg-2019-06_amended-ema-advice_art-37-5.pdf(PDF:2,957KB 外部リンク)
EMA動物用医薬品 Info Day 2021(part2)の概要(2022年1月21日)
2021年11月30日に欧州医薬品庁(EMA)が開催したウェビナーの概要です。
「人医療に使用が限定される抗菌剤を指定する規則」や「第三国からの輸入に関する規制」の現状や今後の見通しに関する情報も含まれています。
EUの新たな動物用医薬品規則の概要(2021年11月1日時点)
(参考)フランスにおける成長促進目的の抗生物質使用食肉の輸入規制
フランスは、成長促進を目的に抗生物質を使用した食肉及び食肉製品の輸入等を禁止する法令を2022年2月21日に公布し、翌日22日に施行しました。
この法令により、フランスに食肉及び食肉製品を輸出する場合、輸出者は、成長促進を目的とした抗生物質の使用がない食肉及びそれに由来する食肉製品であることを証明する必要があります。
証明方法として、2022年4月22日以降、フランスの事業者は、以下の様式の証明書をフランス当局に提示する必要があるとのことです(フランス輸入時の通関で求められるものではありません)。
なお、本法令は、EUの新たな動物用医薬品規則が日本を含めた第三国に適用される日(2026年9月3日)をもって廃止されます。
(参考1)証明書記入例(PDF : 254KB)
本証明に関して、国内の事業者は成長促進を目的とした抗生物質(注:イオノフォアを除く)の使用がない食肉及びそれに由来する食肉製品であることを証明する必要があり、フランスの事業者はフランス当局から証明書を求められた場合に提示する必要があります。
ついては、証明書を求められた場合に速やかに対応できるよう、関係する事業者間で事前の準備、対応を必要に応じて実施してください。
国内では、成長促進を目的とした抗菌性飼料添加物(抗生物質)は流通していませんので、証明書様式の記入や署名に際して、追加で確認することはありません。
(参考)
フランスlegifranceのウェブサイト
https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000045198272(外部リンク)
廃止時期に関する規則
https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000047753636?init=true&page=1&query=AGRG2309426A+&searchField=ALL&tab_selection=all (外部リンク)
3.動物用医薬品等の残留基準値に関する留意事項
動物用医薬品等の使用に当たっては、国内の残留基準値を超過していなくても、EUの残留基準値を超過した場合は輸出することができません。また、国内で承認されていてEUで承認されてない動物用医薬品等は畜産食品中に残留していた場合、EU向けに輸出することができません。動物用医薬品等の使用基準等は国内の残留基準値を超過しないように設定されていますが、EUの残留基準値の方が国内に比べて低い値となっている成分を含む動物用医薬品等については、休薬期間を長めにとるなどの注意が必要です。EU向けに輸出される可能性のある畜産物の由来動物の治療に当たっては、獣医師とよくご相談の上、動物用医薬品等を使用してください。その際、必要な休薬期間が確保されているか出荷時に確認できるよう、投薬歴を記録し、保管してください。
1.EUで使用が禁止されている動物用医薬品等の成分(牛肉)
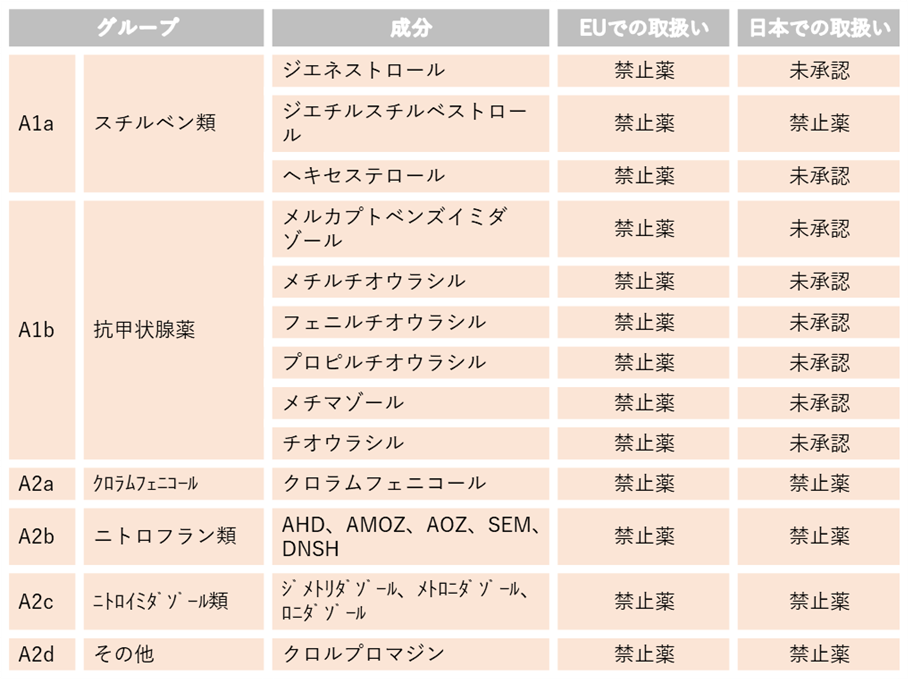
目的いかんによらずEUで使用が禁止されている動物用医薬品等は、牛肉等への残留の有無に関わらず、生涯にわたり使用が禁止されています。国内で流通しているエストラジオール安息香酸エステルとホスホマイシンは、生涯にわたる不使用を確認した上で衛生証明書を発行する体制をとっています。
この項のリストの成分を含む国内未承認薬はEU向けに輸出される可能性のある牛には使用しないでください。なお、日本での取扱いが禁止薬となっているものついては、日本国内でも使用が禁止されています。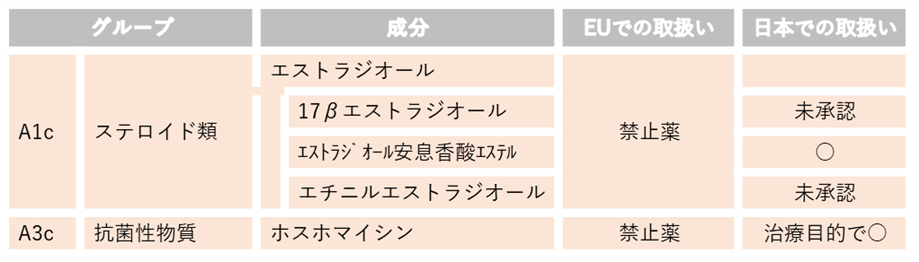
2.EUで未承認又は成長促進目的で使用禁止の動物用医薬品のうち、国内で治療・繁殖目的で使用可能な動物用医薬品等の成分(牛肉)
以下のリストのうちEU未承認薬は牛肉等で検出されると輸出することができないため休薬期間を長めにとるなどの対応が必要です。獣医師と相談の上、使用してください。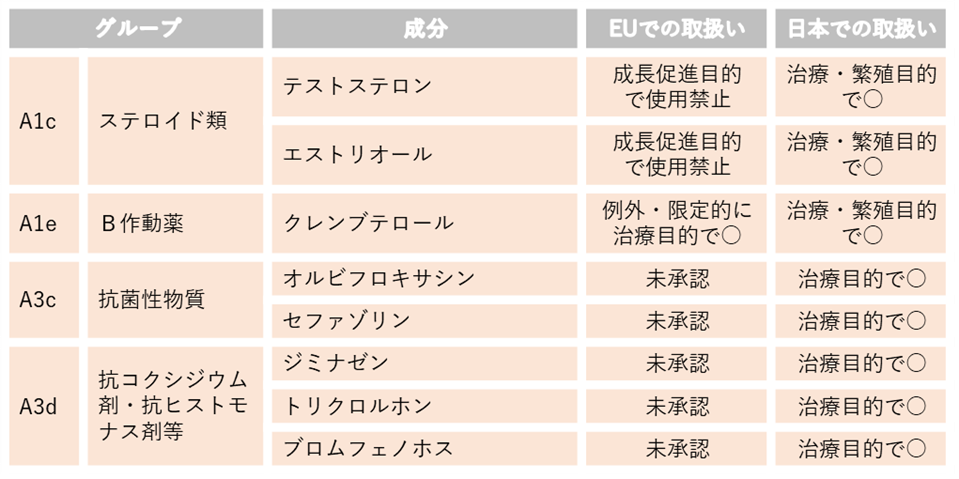
3.EUにおいて未承認又は成長促進目的で使用禁止であって国内でも未承認又は使用禁止の動物用医薬品等の成分(各分類の代表的な成分)(牛肉)
この項のリストの成分を含む国内未承認薬はEU向けに輸出される可能性のある牛には使用しないでください。なお、日本での取扱いが禁止薬となっているものついては、日本国内でも使用が禁止されています。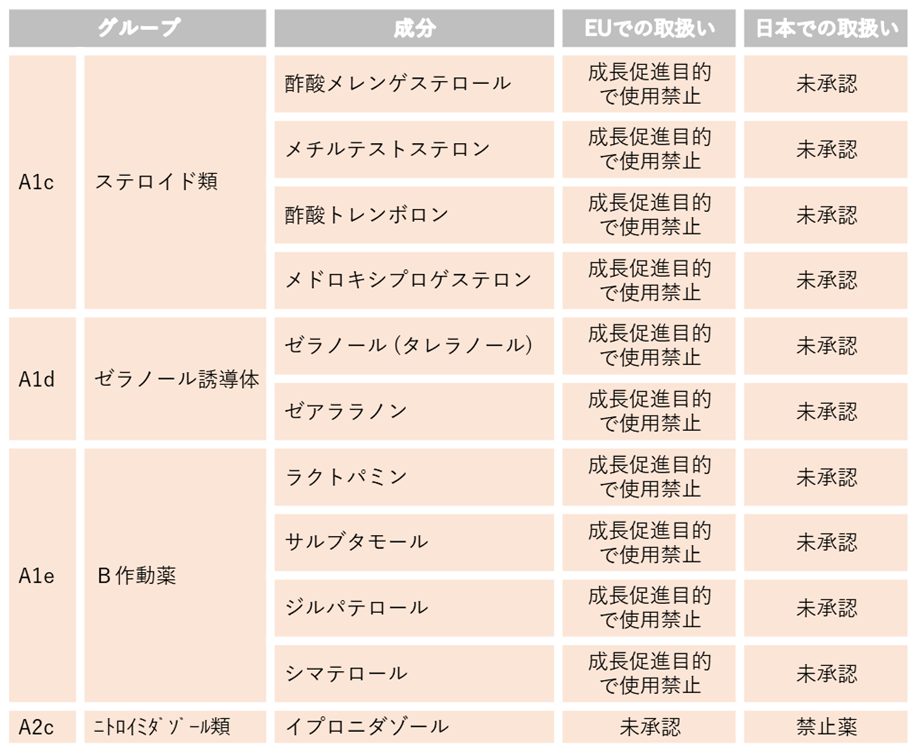
4.EUで基準値が設定されている動物用医薬品等の成分(代表的な成分)(牛肉)
この項のリストのうち、EUの方が低い基準値となっている成分を含む動物用医薬品等については、休薬期間を長めにとるなどの対応が必要です。獣医師と相談の上、使用してください。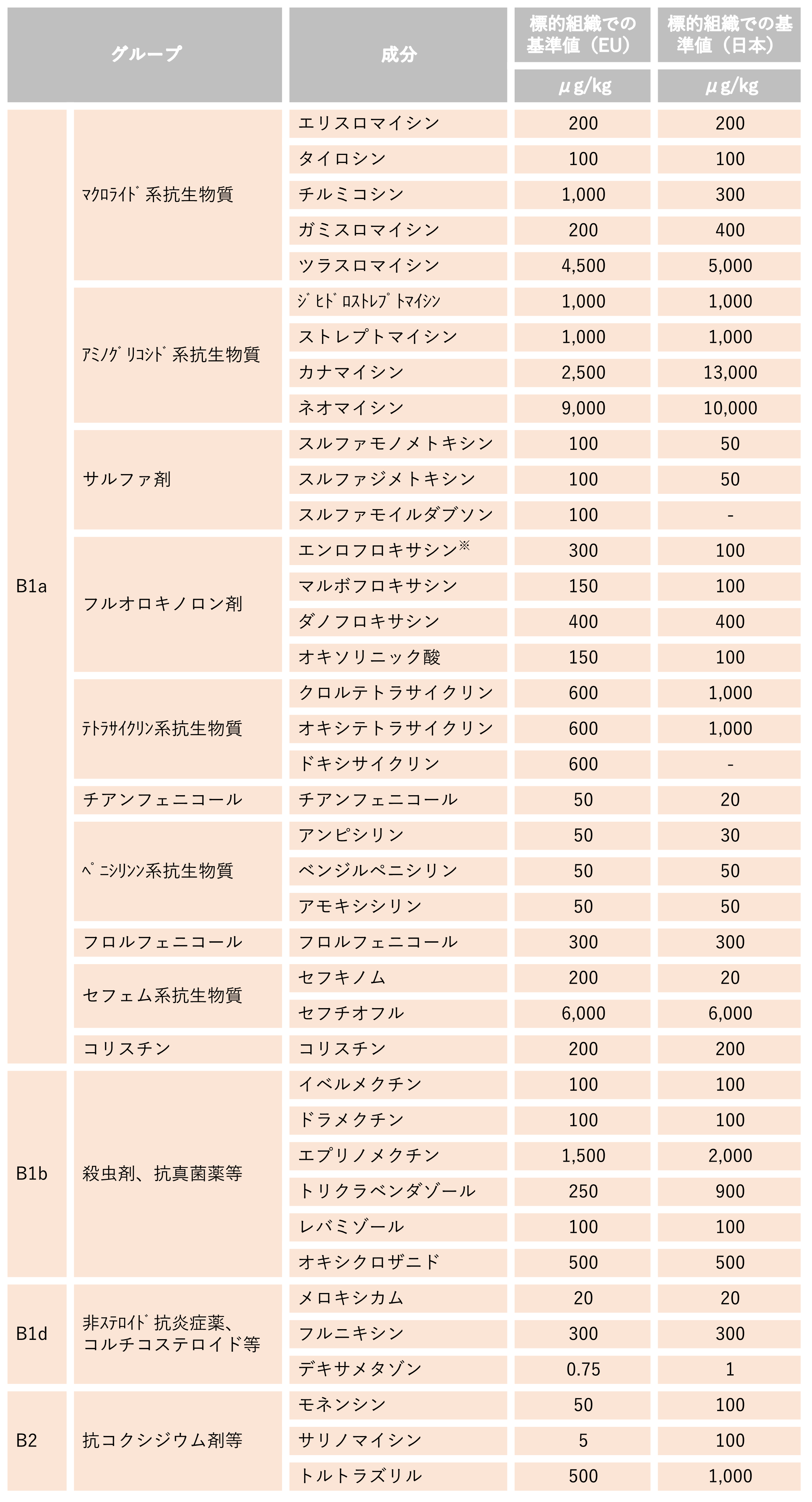
シプロフロキサシンとの和
5.EUで基準値等が設定されている農薬等の成分(代表的な成分)(牛肉)

6.EUで基準値等が設定されている汚染物質等(代表的な汚染物質)(牛肉)
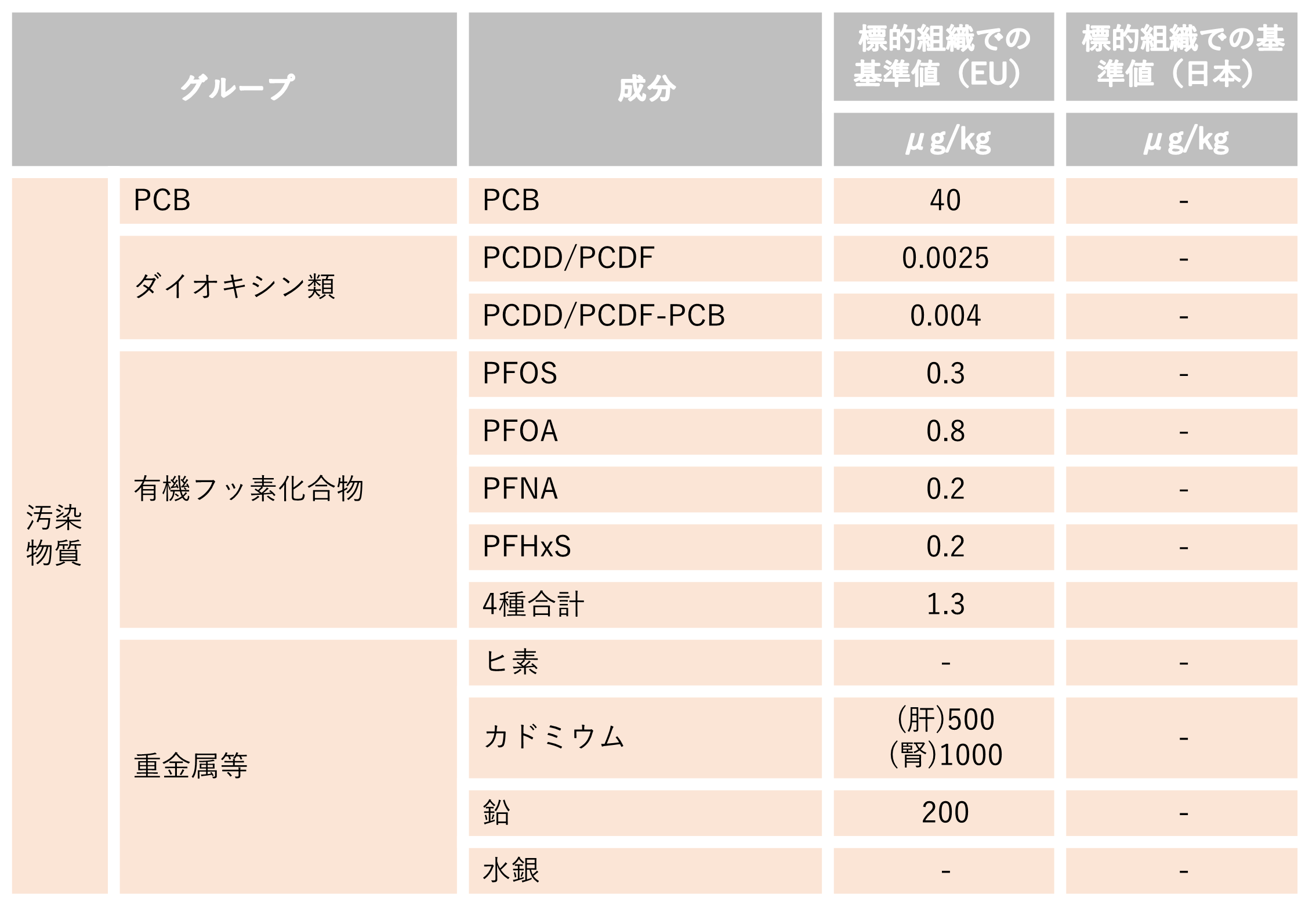
国内基準値はppmの単位で表記することが一般的ですが、EUとの比較の観点から機械的に1000を乗じた値を記載しています(1ppm = 1,000μg/kg) 。
お問合せ先
畜産局食肉鶏卵課
消費・安全局畜水産安全管理課
輸出・国際局規制対策グループ
代表:03-3502-8111(内線4943(食肉鶏卵課)/4536(畜水産安全管理課)/3409(規制対策グループ))
ダイヤルイン:03-6744-2130(食肉鶏卵課)
03-6744-2104(畜水産安全管理課)
03-6744-2378(規制対策グループ)




